일리노이주 노스시카고 애브비가 제29회 유럽 피부과학 및 성병학회(EADV: European Academy of Dermatology and Venereology) 온라인 학술대회에서 유파다시티닙(1일 1회, 15mg 혹은 30mg) 단독 요법으로 아토피피부염에서 피부 개선도와 가려움증 감소가 위약군 대비해 유의하게 개선됨을 보인 최신 분석 데이터를 발표했다.
이 데이터는 미국 식품의약국(FDA) 및 유럽 의약청(EMA)에 린버크를 중등도에서 중증의 아토피피부염을 앓고 있는 성인과 청소년 환자를 위한 치료제로 허가 신청하는 근거가 된 3상 Measure Up 1 및 Measure Up 2 연구에서 비롯됐다.
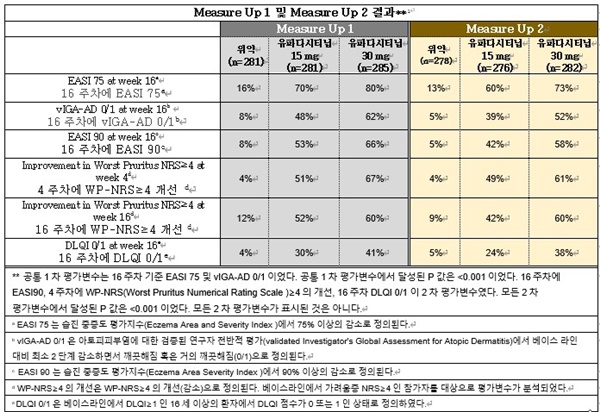
Measure Up 1, 2 두 연구 모두에서 투약 16주차, 위약군에 비해 두 가지 용량 중 한 가지 용량의 유파다시티닙으로 치료받은 경우, 습진중증도평가지수(Eczema Area Severity Index, EASI)에서 90% 이상의 개선을 보인 환자들이 유의하게 더 많았다. (Measure Up 1: 린버크 15/30mg투여군 53/66% 대 위약군 8%, Measure Up 2: 유파다시티닙 15/30mg투여군 42/58% vs 위약군 5 % [p <0.001]).
또한, 4주 차에 두 가지 용량의 유파다시티닙 투약 후 임상적으로 유의미한 가려움증 감소를 보인 환자의 비율 역시 위약군보다 유의하게 높았으며 이는 16주차까지 유지됐다. 임상적으로 유의미한 가려움증 감소는 WP-NRS(Worst Pruritus Numerical Rating Scale ) ≥4일 때 증상이 개선된 것으로 정의했다.
피부과 및 면역학 교수이자 습진과 염증성 피부 질환 연구 센터 소장, 뉴욕 마운트 시나이 아이칸 의과대학 피부과 신임 학과장인 엠마 굿맨 야스키(Emma Guttman-Yassky) 의학 박사는 "유파다시티닙으로 치료받은 환자가 높은 비율로 EASI 90 또는 병변이 거의 없는 피부 상태 및 가려움증에서 유의한 감소에 도달함을 확인하게 되어 정말 기쁘다"고 밝히며, "유파다시티닙의 반응 속도와 정도는 일상 생활을 방해할 수 있는 상당한 질병 부담으로 고통받는 많은 환자들에게 의미가 있다"고 말했다.
올해 이에 앞서, 애브비는 유파다시티닙(15mg 또는 30mg)이 16주차에 습진 중증도 평가 지수(EASI: Eczema Area Severity Index)에서 최소 75%의 개선(EASI 75)과 아토피피부염에 대한 검증된 연구자 전반적 평가(vIGA-AD: validated Investigator's Global Assessment for Atopic Dermatitis) 점수 0/1(깨끗해짐/거의 깨끗해짐)의 공통 1차 평가 변수를 달성했음을 보이는 Measure Up 1 및 Measure Up 2의 주요 데이터를 발표한 바 있다.
아울러, 애브비는 EADV에서 두 가지 용량의 유파다시티닙 투약 16주 후에 위약 대비 유의하게 더 많은 환자들의 삶의 질 평가 지수(DLQI:Dermatology Life Quality Index) 점수가 0/1로 측정되어 삶의 질이 개선되었음을 입증하는 새로운 분석 결과를 발표했다. DLQI는 0에서 30까지 범위로 환자의 건강 관련 삶의 질을 측정하는 척도이며, 점수가 0이나 1일 경우 해당 질병이 더 이상 환자의 삶의 질에 영향을 끼치지 않음을 의미한다.
이러한 추가 데이터는 10월 31일 4:00-4:15 p.m. CET/10:00-10:15 a.m. CT에 열린 유럽 피부과학 및 성병학회 온라인 학술대회(EADV Virtual Congress)의 '최신 뉴스' 세션(Abstract # D3T03.4B)에서 발표됐다.
린버크의 이전 연구와 비교하여 새로운 안전성 위험은 관찰되지 않았다. 이전에 보고된 바와 같이, Measure Up 1의 16주간의 위약 대조 기간 동안 중대한 이상 반응(Serious adverse event)이 보고된 것은 유파다시티닙15mg투여군이 2.1%, 유파다시티닙 30mg 투여군 또는 위약군이 2.8%였다.
Measure Up 2에서 유파다시티닙15mg투여군의 1.8%, 30mg 투여군의 2.5%, 위약군의 2.9%에서 중대한 이상반응이 보고됐다. 심각한 감염은 Measure Up 1과 Measure Up 2모두 드물게 보고됐다. Measure Up 1에서 유파다시티닙 15mg또는 30mg 투여군은 0.7%에서 심각한 감염이 보고됐고, 위약군에서는 관찰되지 않았다.
Measure Up 2에서는 유파다시티닙 15mg투여군의 0.4 %와 30mg 투여군 또는 위약군의 0.7%에서 심각한 감염이 보고됐다. 두 연구 모두 유파다시티닙 투여군에서는 사망, 주요 심혈관 질환(MACE) 또는 정맥혈전색전증(VTE)이 보고되지 않았다. 이 연구의 결과는 발표를 위해 저널에 제출될 예정이다.
우정헌 기자 mtjpost@mtjpost.com
<저작권자 © 메디트리트저널(THE MEDI TRET JOURNAL), 무단 전재 및 재배포 금지>

