식품의약품안전처 15일 국제의약품규제조화위원회(ICH) 산하 국제의약용어(MedDRA) 유지·관리 서비스 기구(MSSO)에서 '국제의약용어(MedDRA) 한국어판'을 배포한다고 밝혔다.
| * 국제의약품규제조화위원회(ICH, The International Council for Harmonisation of Technical Requirements for Pharmaceutical for Human Use) : 의약품 분야의 품질, 안전성, 유효성에 대한 가이드라인을 제정하는 등 국제 의약품 관련 규제 수준을 주도하는 국제 협의체 * MSSOMaintenance·Supporting Service Organization) : ICH 산하 MedDRA 개발 및 유지 관리 서비스 기구 |
국제의약용어(MedDRA)는 전 세계에서 임상시험이나 부작용 보고 등 의약품 개발, 허가 및 시판 후 안전관리 등 전주기 안전관리에 사용하는 국제표준 의약용어(약 10만개의 용어로 구성)이다.
| * MedDRA는 전세계 120개국에서 규제기관, 의약품 개발업체, 제약업체, 임상시험기관, CRO(임상시험수탁기관) 등 5,330개 업체가 사용 중(2018.9월 기준) |
지금까지는 의약품의 임상시험, 허가, 부작용 보고 등에서 WHO-ART 용어를 사용해 왔으나, 식약처가 ICH 정회원으로 가입(2016.11월)함에 따라 2021년에는 국제의약용어(MedDRA)를 의무적으로 사용해야 한다.
| * WHO-ART : WHO에서 개발 및 유지 관리하는 부작용 보고 용어(약6,500개 용어로 구성) |
올해 11월부터 부작용 보고 시스템(KAERS)에 국제의약용어(MedDRA) 한국어판을 탑재해 시범 운영할 계획이다.
식약처는 제약 산업의 해외 진출을 지원하고 의약품 안전관리의 국제조화를 위해 2013년부터 국제의약용어(MedDRA) 한국어판을 준비해 왔다.
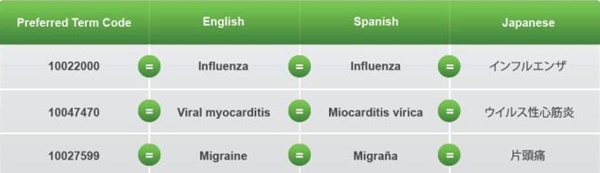
- MedDRA 사용은 전세계적인 추세(미국, 유럽, 일본 도입 완료)이며, IT 기술을 이용한 허가제도(e-CTD 자료 제출 의무화 등) 시행 시 임상시험 기초자료의 표준화된 전자코딩이 선행돼야 하므로 용어의 전자화·표준화가 필수적이다.
국제의약용어(MedDRA) 사용을 위해서 지불해야하는 수수료의 경우, 연매출 1,000만 달러 미만의 중소기업은 무료로 사용할 수 있도록 ICH와 협의해 중소기업의 부담을 해소했다.
| * 스페셜라이센스 : 연 매출액 1,000만 달러 미만 업체가 규제당국 시스템을 통해 이상사례 보고 시 MedDRA 사용료를 면제할 수 있는 제도 |
식약처는 "국제의약용어(MedDRA) 한국어판 배포가 의약품안전관리 국제 조화의 핵심적인 요소가 될 것"이라며 "앞으로도 규제 국제 조화를 위해 더욱더 노력해 나가겠다"고 밝혔다.
우정헌 기자 medi@mediherald.com
<저작권자 © 메디컬헤럴드, 무단 전재 및 재배포 금지>

