'소발디정'(길리어드 C형 간염 치료제) 허가사항 '이상반응' 항목에 '피부 및 피하조직 이상', '스티븐스-존슨 증후군(빈도불명)'이 추가된다.
기존 허가사항에 '피부 및 피하조직 이상' 내용이 허가 반영되어 있던 '하보니'(길리어드)의 경우, '스티븐스-존슨 증후군(빈도불명)'이 추가된다.
식품의약품안전처는 유럽 집행위원회(EC)의 '소포스부비르' 성분제제 관련 안전성 정보에 대한 검토 결과에 따라 품목에 대한 허가 변경이 필요하다고 판단, 허가사항 변경(안)을 마련했다고 지난 9일 밝혔다. '소포스부비르' 성분제제 허가변경 대상<下 파일 참조> 품목은 길리어드 사이언스 코리아 '소발디정', '하보니정' 등 2개 품목이다.
본지가 식약처 '소포스부비르 성분제제 허가사항 변경대비표'<下 표 참조>를 확인한 결과, '소발디정' 이상반응 항목에 '피부 및 피하조직 이상', '스티븐스-존슨 증후군(빈도불명)'이 추가된 것으로 나타났다.
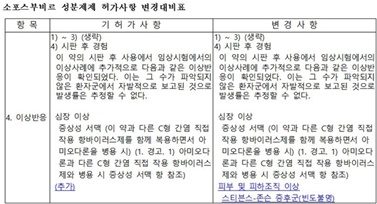
기존 허가사항에 '피부 및 피하조직 이상' 내용이 허가 반영되어 있던 '하보니'의 경우, '스티븐스-존슨 증후군(빈도불명)'이 추가된 것으로 나타났다.
소포스부비르 성분제제 허가사항 변경안에 따르면, '소포스부비르 성분제제(소발디정)' 허가사항 '이상반응' 항목에 '피부 및 피하조직 이상', '스티븐스-존슨 증후군(빈도불명)'이 추가 반영됐다.
소포스부비르 함유제제(하보니정) 허가사항 '이상반응' 항목의 경우, '스티븐스-존슨 증후군(빈도불명)'이 추가됐다.
우정헌 기자 medi@mediherald.com
<저작권자 © 메디컬헤럴드, 무단 전재 및 재배포 금지>

