식품의약품안전처(처장 오유경)는 의료제품 허가심사에 대한 투명성과 신뢰성을 강화하기 위해 11월 4주(11월 21일~11월 27일) 기간 의료제품 허가 현황을 제공한다고 밝혔다.
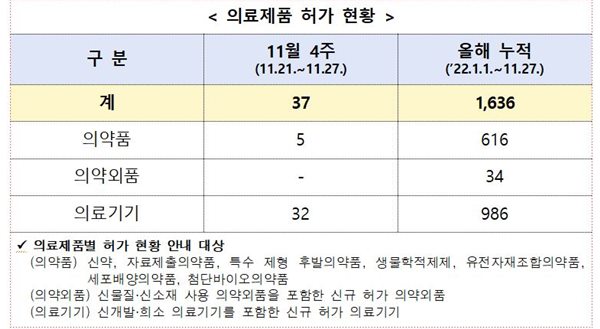
식약처(본부)는 11월 4주(11월 21일~11월 27일)에 의료제품 총 37개 품목을 허가했다. (2022년 누적: 총 1,636개 품목)
지난주에 국소 진행성 또는 전이성 요로상피암을 치료하는 희귀의약품인 ‘발베사정(얼다피티닙)’(한국얀센) 3개 용량(3·4·5mg)을 조건부로 허가(11월 24일)했고, 영유아를 위한 코로나19 초기 바이러스 백신인 ‘코미나티주0.1mg/mL(6개월-4세용)(토지나메란)’(한국화이자제약)을 허가(11월 25일)했다.
식약처 ‘11월 4주 의료제품 허가 품목 리스트 의약품 현황’에 따르면, ‘애크린겔’(살리실산)(동아제약), ‘발베사정3밀리그램’(얼다피티닙)(한국얀센), ‘코미나티주0.1mg/mL’(6개월-4세용)(토지나메란)(사스코로나바이러스-2 mRNA 백신)(한국화이자제약) 등이 포함됐다.
식약처는 “앞으로도 의료제품 허가 현황을 정례적으로 매주 제공하겠으며, 의료제품별 상세한 허가사항은 전자민원시스템에서 확인할 수 있다”고 밝혔다.
우정헌 기자 medi@mediherald.com
<저작권자 © 메디컬헤럴드, 무단 전재 및 재배포 금지>

