식품의약품안전처(처장 오유경)는 ‘품목 조건부 허가제도’의 운영 투명성과 예측 가능성을 높이기 위해 관련 조건부 허가 대상 등 최근 법령 개정사항을 반영한 '의약품 품목 조건부 허가 관리 지침'(안내서) 개정판을 마련·배포했다고 1일 밝혔다.
| * 「의약품 등의 안전에 관한 규칙」(총리령) 개정 주요 내용(시행일: ’22.7.21.) 품목 조건부 허가 대상 규정: 생명을 위협하는 중대질환 치료제, 희귀의약품 품목 조건부 허가 신청자료 규정: 품목 조건부 허가 대상 입증자료, 품목허가 신청자료 허가 후 임상시험 실시상황 보고 기한: 매년 3월 |
주요 내용은 ▲조건부 허가 대상 명시 ▲허가조건 이행 여부 보고 세부 절차 안내 ▲조건부 허가 신청서와 허가증 양식반영 ▲변경된 정기보고 일자(1월→3월) 반영 ▲중앙약사심의위원회 의무 개최 등 개정된 조건부 허가 절차 안내이다.
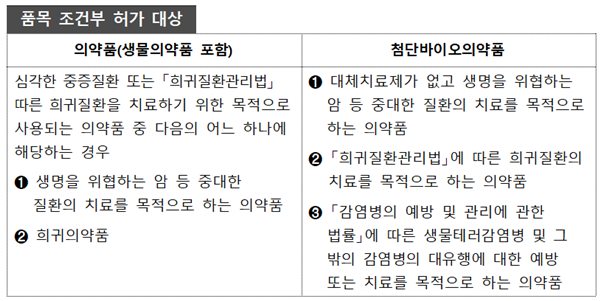
품목 조건부 허가제도는 항암제 등 중대 질환 치료제, 희귀의약품 등의 경우에 임상적 효과를 합리적으로 예측할 수 있는 임상시험자료 등을 근거로 안전성·유효성 등을 확증하기 위한 투약자 대상 임상시험 자료를 허가 후 별도로 정하는 기간 내에 제출하는 것을 조건으로 허가하는 제도이다.
식약처는 "이번 개정 안내서 발간으로 업계가 품목 조건부 허가제도에 대해 분명하게 이해해 품목 조건부 허가 신청, 이행 여부 보고 등 업무를 원활히 수행하는 데 도움을 줄 것으로 기대한다"고 밝혔다.
이어 "앞으로도 규제혁신과 적극행정을 바탕으로 품목 조건부 허가·심사 과정을 투명하고 효율적으로 운영해 국민이 안전하고 효과적인 의약품을 신속하게 사용할 수 있도록 최선을 다하겠다"고 밝혔다.
우정헌 기자 medi@mediherald.com
<저작권자 © 메디컬헤럴드, 무단 전재 및 재배포 금지>

