식품의약품안전처(처장 김강립)는 지난해 의약품 허가·신고 현황을 담은 '2021년 의약품 허가 보고서'를 4월 7일 발간했다고 밝혔다.
지난해 의약품 허가·신고된 품목은 총 2,270개 품목으로 주요 특징은 ▲국내 개발 신약 5개 허가로 역대 최고 ▲코로나19 백신 6개 허가 ▲국내 개발 코로나19 치료제 첫 허가 ▲제네릭의약품 큰 폭 감소, ‘새로운 조성’ 의약품 절반 차지 ▲‘순환계용 의약품’이 약효군 중 1위로 증가세 ▲첨단바이오의약품 전 주기 안전관리 체계 본격 가동이다.
◆'국내 개발 신약 5개 허가'로 역대 최고= 신약 37개 품목(28개 성분)을 허가했으며, 그중 국내 개발 신약이 5개 품목(5개 성분)으로 국내 개발 신약 허가 품목 수를 집계하기 시작한 1999년 이후 최고치를 기록했다.
신약 37개 허가 품목에 '칼퀀스캡슐100밀리그램'(한국아스트라제네카), '탁자이로주'(한국다케다제약), '코미나티주'(한국화이자제약), '코비드-19백신얀센주'(한국얀센), '싱그릭스주'(글락소스미스클라인)(GSK), '베르쿠보정2.5밀리그램'(바이엘코리아) 등이 포함됐다.
국내 개발 신약 5개 품목은 레이저티닙(유한양행 '렉라자정80밀리그램')(비소세포폐암), 레그단비맙(셀트리온 '렉키로나주960mg')(코로나19 항체치료제), 에플라페그라스팀(한미약품 '롤론티스프리필드시린지주')(호중구감소증), 백부근등 한약추출물(한미약품 '브론패스정')(급성기관지염), 펙수프라잔(대웅제약 '펙수클루정40밀리그램') 등으로 집계됐다.
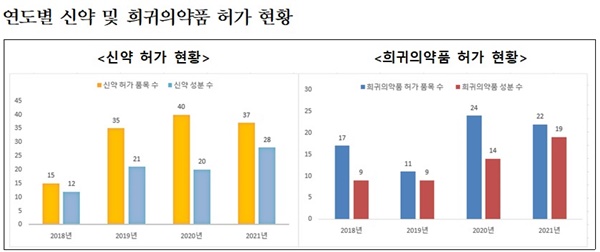
아울러, 희귀·난치성 환자의 치료 기회 확대를 위한 희귀의약품은 22개 품목(19개 성분)을 허가해 전년 수준을 유지했다.
◆'코로나19 백신 6개(4개 성분)' 허가= 2021년 2월 '한국아스트라제네카백스제브리아주'를 코로나19 백신으로 국내 처음으로 허가한 이후 지난해 총 6개 품목(4개 성분)의 백신을 허가했다. 이 중 '한국아스트라제네카백스제브리아주'(SK바이오사이언스 제조, 바이러스벡터 방식), '스파이크박스주'(삼성바이오로직스 제조, mRNA 방식) 등 2개 품목은 국내 제조로 허가했다.
식약처는 코로나19 치료제·백신을 허가하는 과정에서 전문성과 객관성을 강화하고자 '약사법'에 따른 중앙약사심의위원회, 코로나19 치료제·백신 안전성 효과성 검증자문단, 최종점검위원회의 3중 자문을 진행했다.
◆국내 개발 코로나19 치료제 첫 허가= 국내 의약품 제조업체가 개발한 코로나19 항체치료제 ‘렉키로나주960mg(레그단비맙)’을 처음으로 허가했다. '렉키로나주960mg(레그단비맙)'는 전 세계에서 세 번째로 의약품 규제기관에서 안전성과 효과성을 검증한 코로나19 치료제이다.
◆제네릭의약품 큰 폭 감소…'새로운 조성' 의약품 절반 차지= 제네릭의약품의 허가·신고 품목 수는 큰 폭으로 감소해 전년(’20년) 대비 약 41% 감소했다.
동일한 임상(생동)시험자료를 이용할 수 있는 품목 수를 3개로 제한하는 '약사법' 개정(’21.7월)이 제네릭의약품 허가·신고 품목 수 감소에 영향을 미친 것으로 분석된다.
한편, 허가한 280개 자료제출의약품 중 ‘새로운 조성’ 의약품이 137개로 전체의 절반(48.9%) 가까이 차지했다. 그중 고지혈증 치료제(에제티미브 복합제)가 80개(58.4%)를 차지했고, 이는 고지혈증의 치료제 시장에서 제약업체 간의 경쟁이 매우 치열할 것으로 예상된다.
◆'순환계용 의약품' 약효군 중 1위로 증가세= 약효군별로 분류했을 때 ‘혈압강하제’ 등이 포함된 ‘순환계용 의약품’이 526개 품목으로 26.3%를 차지해 1위였다. '순환계용 의약품'은 전년(581개 품목, 18.7%)에 이어 1위를 차지한 것으로 전체에서 차지하는 비중은 7.6%p 증가했으며, 고령화 등 혈압약 시장의 지속적 확대에 따른 것으로 분석된다.
뒤이어 ‘당뇨병용제 및 기타의 대사성 의약품’ 387개 품목(19.4%), ‘신경계용 의약품’ 243개 품목(12.2%), ‘소화기관용 의약품’ 171개 품목(8.6%), ‘혈액 및 체액용약’ 168개 품목(8.4%), ‘알레르기용약’ 38개 품목(1.9%), ‘항생물질제제’ 20개 품목(1.0%) 순이었다.
◆'첨단바이오의약품 전 주기 안전관리 체계' 본격 가동= 기존 '약사법'에 따라 허가된 ‘세포치료제’ 중 15개 품목이 2020년 8월 시행된 '첨단재생의료 및 첨단바이오의약품 안전 및 지원에 관한 법률'(이하 '첨단재생바이오법')에 따라 재허가됐으며, 신규로 '유전자치료제' 3개 품목을 허가했다.
'첨단재생바이오법'에 따라 허가되는 첨단바이오의약품의 경우 장기추적 관리 등 전 주기 안전관리가 강화되며, 환자에게 보다 안전하고 신속한 치료 기회가 제공된다.
식약처는 "앞으로도 국내 의약품 업계의 연구·개발 지원을 위해 국내 의약품 허가·신고 현황과 분석 정보를 지속적으로 제공하겠다"고 밝혔다.
우정헌 기자 medi@mediherald.com
<저작권자 © 메디컬헤럴드, 무단 전재 및 재배포 금지>

