식품의약품안전처(처장 김강립)는 동일한 임상시험 자료를 활용해 추가로 허가받을 수 있는 의약품 품목 수를 3개까지로 제한하는 제도가 '약사법' 개정(’21.7.20.)으로 시행됨에 따라, 의약품 품목허가·신고 신청 시 작성해야 하는 항목과 입력 요령을 안내한다고 27일 밝혔다.
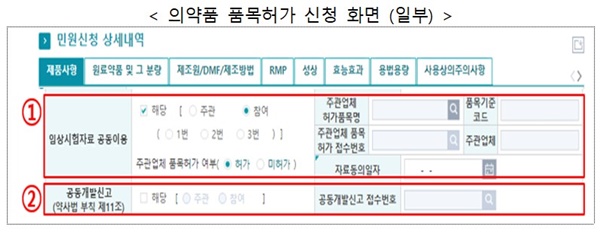
의약품 품목허가‧신고 신청 시 신규로 입력해야 하는 항목은 ▲임상시험 자료 공동이용 또는 ▲공동개발신고이다.

임상시험 자료 공동이용 항목은 임상시험 자료를 공동으로 이용한 품목의 경우 작성하며 신청 업체의 임상시험 주관 또는 참여 등 역할을 입력하고, 주관 업체 품목의 허가 또는 허가 신청 정보(접수번호 등)도 입력한다.
개정 '약사법' 시행(’21.7.20.) 당시 다수의 의약품 제조업자가 공동으로 개발하기로 하고 임상시험(생물학적 동등성시험을 포함)계획을 승인받아 ‘공동개발 신고’(기한: ’21.8.19.)한 품목은 ‘공동개발신고’ 항목을 입력한다.
식약처는 "임상시험 자료 공동이용 제한 제도가 안정적으로 정착되면 제약업계의 경쟁력이 강화될 것으로 기대하며, 앞으로도 우수한 품질의 의약품이 개발·공급될 수 있도록 노력하겠다"고 밝혔다.
품목허가·신고 신청에 대한 자세한 사용법은 의약품안전나라>공지사항에 게시된 사용자매뉴얼을 통해서 확인할 수 있다.
우정헌 기자 medi@mediherald.com
<저작권자 © 메디컬헤럴드, 무단 전재 및 재배포 금지>

