지난해 합성의약품 임상시험은 476건으로 2018년(415건) 대비 14.7% 증가했으며, 바이오의약품 임상시험은 202건으로 2018년(233건) 대비 13.3% 감소한 것으로 나타났다.
바이오의약품 중 유전자재조합은 132건으로 2018년(177건) 대비 25.4% 감소한 반면, 생물학적제제는 36건으로 2018년(23건) 대비 56.5% 증가한 것으로 나타났다.
제약사별로는 국내 제약사의 경우 종근당이 23건으로 가장 많았고, 대웅제약(17건), 한미약품(9건) 등의 순이었다. 다국적 제약사는 한국MSD(27건), 한국노바티스(18건), 한국릴리(12건), 한국아스트라제네카(12건) 순으로 나타났다.
식품의약품안전처(처장 이의경)와 국가임상시험지원재단은 2019년 임상시험계획 승인 현황을 공동 분석한 결과, 전체 승인건수는 714건으로 2018년(679건) 대비 5.2% 증가하며 최초로 700건을 넘었다고 3일 밝혔다.
식약처는 임상시험이 꾸준히 증가하고 있는 만큼 참여자 안전과 권리보호를 최우선으로 관리를 강화하고, 임상시험 심사체계를 효율적이고 합리적으로 개선할 계획이라고 밝혔다.
지난해 임상시험의 주요 특징은 ▲임상시험 승인 꾸준히 증가 ▲국내 진행 3상 임상시험 활발 ▲중추신경계・호흡기계・심혈관계 질환 임상시험 증가 등이다.
◆임상시험 승인 꾸준히 증가= 지난해 임상시험 승인건수는 714건으로, 2018년(679건) 대비 5.2% 증가했으며, 2017년(658건) 보다는 8.5% 증가하며 최근 3년간 꾸준한 증가세를 보였다.
이에 반면 전 세계 임상시험 신규 등록건수는 지난해 8,196건으로 2018년(8,386건)에 비해 2.3% 감소했다. 이처럼 전 세계 추세와 다르게 국내 임상시험이 증가한 것은 국내 임상시험 역량이 향상된 것을 보여준다고 할 수 있다.
◆국내 3상 임상시험 증가= 의약품 개발을 위한 '제약사 임상시험'을 단계별로 살펴보면, 1상 임상시험은 2018년과 유사한 수준을 유지했으며, 2상 임상시험과 3상 임상시험은 2018년 대비 각각 10.2%, 10.6% 증가했다.
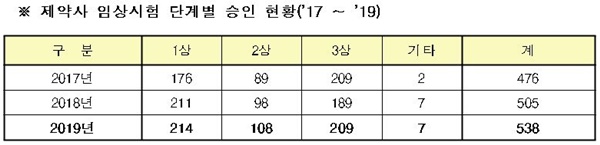
또한, 국내에서만 실시하는 3상 임상시험(국내임상)의 경우 지난해 50건이 승인되며, 2018년 대비 56.3% 증가한 것으로 나타났다.
이러한 '국내 임상'의 증가는 허가 신청을 앞둔 의약품의 개발이 활발하게 진행되는 것으로 풀이되며, 높아진 국내 의약품 개발 역량을 나타낸다고 볼 수 있다.
◆효능별 임상시험 승인현황= 임상시험 승인 현황을 효능군 별로 살펴보면, 항암제(207건), 내분비계(69건), 소화기계(65건), 심혈관계(60건) 등의 순으로 많았다.
대표적인 중증질환인 암 치료제 개발을 위한 항암제 임상시험은 전체 임상시험의 29.0%를 차지하며, 3년 연속 가장 높은 비율을 나타냈다.
중추신경계 임상시험은 지난해 54건으로 2018년(33건) 대비 크게 증가(63.6%) 했으며, 주요 질환으로는 알츠하이머, 우울증, 뇌졸중 등에 대한 임상시험이 진행 중에 있다.
지난해 호흡기계 임상시험은 23건, 심혈관계 임상시험은 60건으로 2018년 대비 각각 27.8%(18건→23건)와 22.4%(49건→60건) 증가했으며, 주요 질환으로는 천식, 만성폐쇄성폐질환, 특발성폐섬유증 등에 대한 임상시험이 진행 중에 있다.
이밖에 19세 미만 소아 대상 임상시험은 51건(7.1%)으로 효능별로는 중추신경계(11건), 심혈관계(6건), 호흡기계・항암제(각 4건) 등의 순이었으며, 투렛증후군, 소아폐동맥 고혈압 등에 대한 임상시험이 진행 중에 있다.
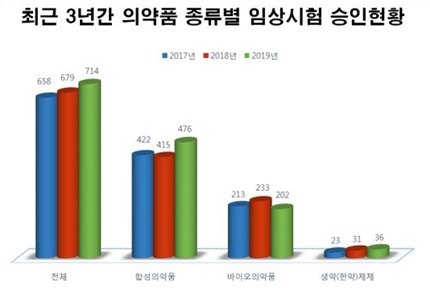
◆'국내 제약사 임상 시험 계획 승인' 종근당 23건 '최다'…대웅제약 17건·한미약품 9건= 지난해 합성의약품 임상시험은 476건으로 2018년(415건) 대비 14.7% 증가했으며, 바이오의약품 임상시험은 202건으로 2018년(233건) 대비 13.3% 감소한 것으로 나타났다.
바이오의약품 중 유전자재조합은 132건으로 2018년(177건) 대비 25.4% 감소한 반면, 생물학적제제는 36건으로 2018년(23건) 대비 56.5% 증가한 것으로 나타났다.
제약사별로는 국내 제약사의 경우 종근당이 23건으로 가장 많았고, 대웅제약(17건), 애드파마(11건), 씨제이헬스케어(9건), 한미약품(9건) 등의 순이었다.
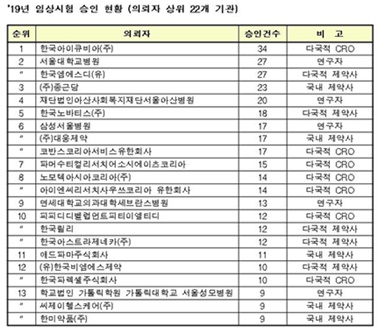
다국적 제약사는 한국엠에스디(한국MSD)(27건), 한국노바티스(18건), 한국릴리(12건), 한국아스트라제네카(12건) 순이었다.
연구개발 수탁전문기업(CRO)은 한국아이큐비아(34건), 코반스코리아서비스유한회사(17건), 파머수티컬리서치어소시에이츠코리아(15건) 순이었다.
연구자 임상시험은 서울대학교병원이 27건으로 가장 많았고, 재단법인아산사회복지재단서울아산병원(20건), 삼성서울병원(17건), 연세대학교의과대학세브란스병원(13건) 등의 순으로 나타났다.
우정헌 기자 medi@mediherald.com
<저작권자 © 메디컬헤럴드, 무단 전재 및 재배포 금지>

