식품의약품안전처가 1~2분기 신(新) 의료제품 허가 목록에 국내에서 개발한 수두백신으로 GC녹십자 '배리셀라주'가 포함된 가운데, GC녹십자(대표 허은철<사진>)는 수두백신 '배리셀라주'를 통해 전세계 약 23억 달러 규모로 예상되는 글로벌 수두백신 시장 공략을 예고하고 있어 향후 귀추가 주목된다.

특히, 국내에서 개발한 GC녹십자 허은철號(호)의 '배리셀라주'는 수입에 의존하던 수두 백신의 안정적 공급에 기여할 전망이다.
메디컬헤럴드가 식품의약품안전처가 발표한 '1분기~2분기 신(新) 의료제품 허가 품목 현황'<下 표 참조>을 확인한 결과, 1분기 신(新) 의료제품 허가 품목의 경우, 한국화이자제약 '크레셈바주200㎎, 캡슐100㎎', 한국애브비 ' 벤클렉스타정10·50·100mg', 녹십자 '배리셀라주' 등이 포함된 것으로 나타났다.
2분기 '신의료제품 허가품목의 경우, 한국로슈 '로즐리트렉캡슐100·200mg', 한독 '울토미리스주', 한국얀센 '다잘렉스피하주사' 등이 포함된 것으로 나타났다.
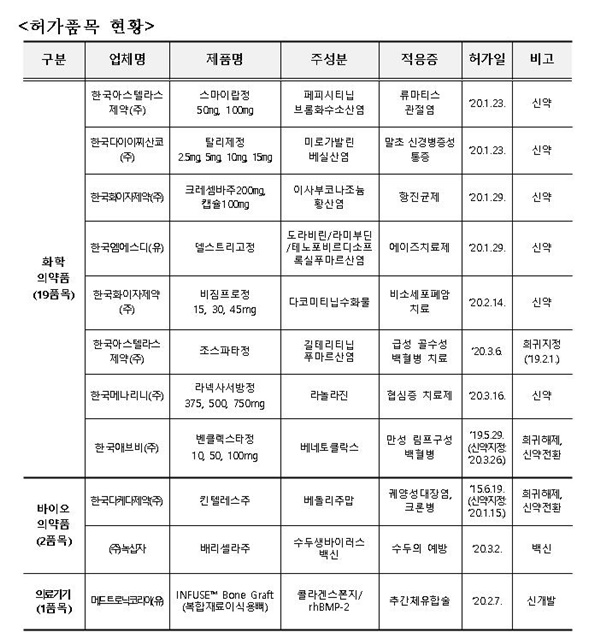
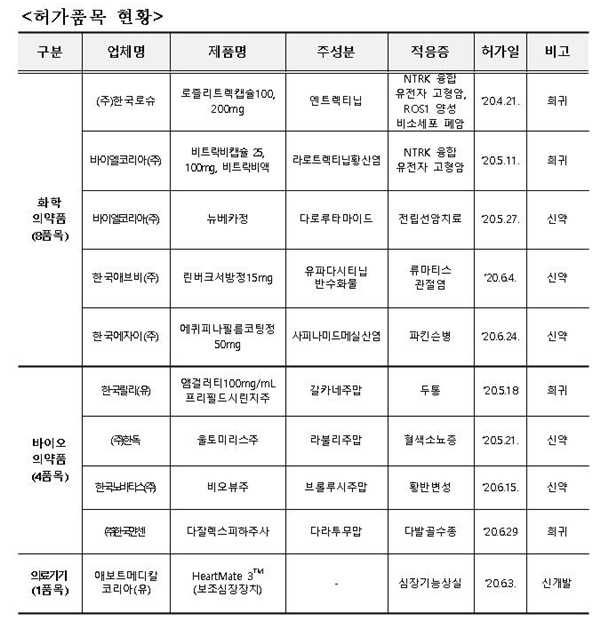
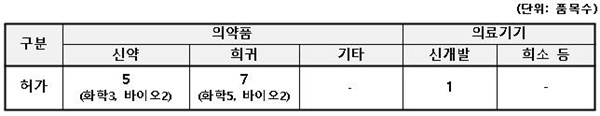
2분기 신의료제품에는 신약 5개 품목을 비롯해 희귀의약품 7개 품목, 신개발 의료기기 1개 품목 등 총 13개 신의료제품이 허가됐다.
특히, 식품의약품안전처가 1~2분기 신(新) 의료제품 허가 목록에 국내에서 개발한 수두백신으로 GC녹십자 '배리셀라주'가 포함된 가운데, GC녹십자(대표 허은철)는 수두백신 '배리셀라주'를 통해 전세계 약 23억 달러 규모로 예상되는 글로벌 수두백신 시장 공략을 예고하고 있어 향후 귀추가 주목된다.
특히, 국내에서 개발한 GC녹십자 허은철號(호)의 '배리셀라주'는 수입에 의존하던 수두 백신의 안정적 공급에 기여할 전망이다.
GC녹십자에 따르면, '배리셀라주'는 기존 수두백신과 같이 바이러스 약독화 과정을 거친 생백신으로, 품질과 생산성이 향상된 수두백신이다. 생산성 향상을 통해 수율이 크게 증가했으며, 생바이러스 함유량을 높임과 동시에 제품의 안정성도 한층 개선했다.
GC녹십자는 '배리셀라주'가 생후 12개월 이상, 만 12세 이하 소아를 대상으로 태국과 국내에서 진행된 다국가 임상 3상에서 대조약 대비 비열등성을 입증해 유효성과 안전성을 확인했다고 설명했다.
백신의 품질 향상과 함께 전반적인 GMP(의약품 제조 및 품질관리기준) 공정 수준도 개선해 생산성을 높였다. 특히, 무균공정시스템을 통해 현재 전 세계에서 유일하게 항생제 없이도 수두백신 생산이 가능하다는 게 GC녹십자의 설명이다.
우정헌 기자 medi@mediherald.com
<저작권자 © 메디컬헤럴드, 무단 전재 및 재배포 금지>

