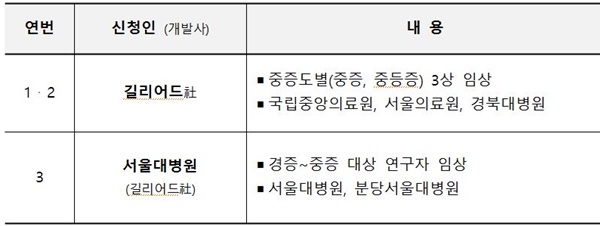
식품의약품안전처는 '렘데시비르'(임상 신청인 길리어드社) 성분 의약품이 코로나19 치료제로서 현재 국내에서 3건의 임상시험을 진행하고 있다고 밝혔다.
다만, 해당 의약품은 현재 임상시험이 진행되고 있어 코로나19 치료제로서 안전성·유효성을 판단할 단계는 아니며, 국내외 임상시험 진행 상황을 예의주시하고 있다. '렘데시비르' 임상 신청인(개발사)는 길리어드社이다.
식약처는 "현재 미국 국립보건원(NIH) 산하 연구소인 국립알레르기‧전염병연구소(NIAID)에서 발표한 '렘데시비르'의 코로나19 임상시험에서 긍정적 효과를 보였다는 보도와 관련, 렘데시비르의 유효성 판단을 위해서는 각 군당 분석 대상자 수, 시험대상자 정보(증상발현 정도 등) 등이 함께 검토돼야 하며, 안전성 판단을 위해서는 이상반응, 중도 탈락율 등 평가에 필요한 정보가 확인돼야 하므로, 정확한 판단을 위해서는 추가적인 자료가 필요한 상황"이라고 밝혔다.
식약처는 "현재 코로나19 치료제가 없는 긴급한 상황을 고려해 해당 의약품이 치료제로서 효능이 입증되고 기대 효과가 안전성을 상회한다고 판단되면, 특례 수입 등을 통해 코로나19 환자에게 사용될 수 있도록 적극적으로 조치할 계획"이라고 밝혔다.
우정헌 기자 medi@mediherald.com
<저작권자 © 메디컬헤럴드, 무단 전재 및 재배포 금지>

