품목 허가 공시항목, 임상시험 공시항목 등 '제약·바이오 기업 공시 투명성 제고를 위한 가이드라인'이 발표됐다.
임상시험 공시 항목의 경우, ▲임상시험 계획 신청(변경신청) 및 결과, ▲임상시험 중지, 의약품 등의 사용금지 등 조치, ▲임상시험 종료 및 임상시험 결과 등이 해당된다.
품목 허가 공시 항목의 경우, ▲품목허가 신청 및 결과, ▲품목허가 취소, 판매․유통금지 등 조치, ▲GMP 부적합 판정 등이 해당된다.
금융위원회(금융위)는 '제약·바이오 기업 공시 투명성 제고를 위한 가이드라인'을 10일 밝혔다.
금융위는 제약․바이오 업종 특성을 고려한 맞춤형 가이드라인을 제공해 ▲공통으로 발생하는 주요 경영사항에 대한 명확한 공시기준 제시, ▲공시정보를 충실히 제공할 수 있도록 모범사례(Best Practice) 제공, ▲투자자가 위험을 명확히 인지할 수 있도록 내용 구성(주의문구 삽입 등)으로 제시했다.
◆'품목 허가 공시' 항목 등 제약·바이오 업종 맞춤형 공시 기준 제시= 공통적으로 발생하는 중요 경영활동을 임상시험, 품목허가, 기술도입‧이전계약, 국책과제, 특허권 계약 등으로 구분하고, 카테고리 別로 공시해야 할 항목을 구체적으로 제시했다.
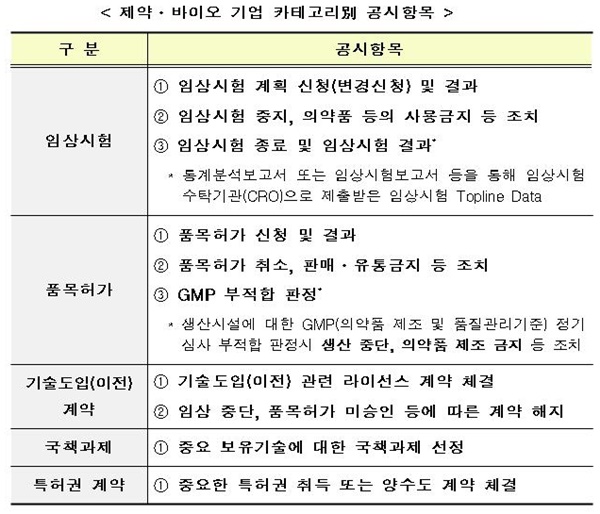
임상 시험 공시 항목의 경우, ▲임상시험 계획 신청(변경신청) 및 결과, ▲임상시험 중지, 의약품 등의 사용금지 등 조치, ▲임상시험 종료 및 임상시험 결과 등이 해당된다. 임상시험 종료 및 임상시험 결과에는 통계분석보고서 또는 임상시험보고서 등을 통해 임상시험수탁기관(CRO)으로 제출받은 임상시험 Topline Data가 포함됐다.
품목 허가 공시 항목의 경우, ▲품목허가 신청 및 결과, ▲품목허가 취소, 판매․유통금지 등 조치, ▲GMP 부적합 판정 등이 해당된다.
기술도입(이전)계약 공시 항목이 경우, ▲기술도입(이전) 관련 라이선스 계약 체결, ▲임상 중단, 품목허가 미승인 등에 따른 계약 해지 등이 해당된다.
◆'Best Practice' 주요 공시정보 상세히 제공= 제약․바이오 기업 경영활동 관련 중요정보가 빠짐없이 상세히 공시될 수 있도록 항목별 공시사항을 제시하고 모범 공시양식(Best Practice)을 제공했다.

◆'주의 문구 삽입' 등 투자위험 명확히 안내= 투자자가 임상시험, 품목허가, 기술이전계약 관련 리스크를 충분히 인지하고 투자판단 할 수 있도록 주의문구를 삽입했다.

합리적 투자판단에 혼란을 줄 수 있는 불확실한 정보에 대해서는 공시를 제한했다. 예를 들어 홍보성 정보로 (A사) '임상시험 3상 진행 관련 첫 임상환자 등록', (B사) '임상 3상 승인을 위한 FDA 대면 미팅 예정' 등이 해당된다.

공시내용을 오도할 수 있는 제목, 내용 이해가 어려운 제목 등을 지양하고, 간결하고 이해하기 쉬운 제목 사용 권장했다.
우정헌 기자 medi@mediherald.com
<저작권자 © 메디컬헤럴드, 무단 전재 및 재배포 금지>

